| 反应性 | H M R Mk |
| 灵敏度 | 内源性 |
| MW (kDa) | 79, 86 |
| 来源/同种型 | 兔 IgG |
产品信息
为了获得最佳的 ChIP 和 ChIP-seq 结果,每次免疫沉淀使用 5 μl 抗体和 10 μg 染色质(大约 4 x 106 个细胞)。该抗体已使用 SimpleChIP® Enzymatic Chromatin IP Kits 进行验证。
| 应用 | 稀释度 |
|---|---|
| 蛋白质印迹法 | 1:2000 |
| Simple Western™ | 1:10 - 1:50 |
| 免疫沉淀法 | 1:100 |
| IHC Leica BOND | 1:100 - 1:400 |
| 免疫组织化学(石蜡) | 1:100 - 1:400 |
| 免疫荧光法(免疫细胞化学) | 1:100 - 1:200 |
| 流式细胞术(固定/通透) | 1:100 - 1:400 |
| 染色质免疫沉淀法 | 1:100 |
| ChIP-seq | 1:100 |
为了进行蛋白质印迹,在 4°C 将膜与 5% w/v BSA、1X TBS、0.1% Tween® 20 中稀释的一抗孵育过夜,同时柔和振摇。
注意:请参阅一抗产品网页了解推荐的抗体稀释度。
从样品制备至检测,进行蛋白质印迹所需要的试剂现归于一个便利的试剂盒:#12957 Western Blotting Application Solutions Kit
注:使用反渗透去离子水 (RODI) 或同等级别的水配制溶液。
上样 20 µl 到 SDS-PAGE 凝胶 (10 cm x 10 cm) 上。
注意:建议将预染蛋白分子量标准品(#59329,10 µl/泳道)上样,以验证转膜的效率,生物素化蛋白质标准品(#7727,10 µl/泳道)可以直接在膜上显出条带以确定分子量。
注意:体积适用于 10 cm x 10 cm (100 cm2) 的膜;对于不同尺寸的膜,可相应调整体积。
* 避免反复接触皮肤。
发布时间 2005 年 6 月
修订时间 2020 年 6 月
实验步骤编号:10
本实验步骤适用于使用 Protein A agarose beads 对天然蛋白进行免疫沉淀,以进行蛋白质免疫印迹或激酶活性分析。
注:使用反渗透去离子水 (RODI) 或同等级别的水配制溶液。
10X 细胞裂解缓冲液:(#9803) 要制备 10 ml 的 1X 细胞裂解缓冲液,将 1 ml 细胞裂解缓冲液添加至 9 ml dH2O,并混合。
注意:使用前,请立即添加 1 mM PMSF (#8553)。
重要提示:强烈建议使用相应的同型对照,以便在你的一抗免疫沉淀中显示特异性结合。把 Normal Rabbit IgG #2729 用于多克隆一抗,把 Rabbit (DA1E) mAb IgG XP® Isotype Control #3900 用于兔单克隆一抗,把 Mouse (G3A1) mAb IgG1 Isotype Control #5415 用于小鼠 IgG1 单克隆一抗,把 Mouse (E5Y6Q) mAb IgG2a Isotype Control #61656 用于小鼠 IgG2a 单克隆一抗,把 Mouse (E7Q5L) mAb IgG2b Isotype Control #53484 用于小鼠 IgG2b 单克隆一抗,Mouse (E1D5H) mAb IgG3 Isotype Control #37988 用于小鼠 IgG3 单克隆一抗。同型对照的浓度应匹配,并与一抗样品同时进行。
继续下述其中一项的具体步骤。
注意:当使用兔源一抗检测分子量在 50 kDa 范围内的蛋白质时,我们建议使用 Mouse Anti-Rabbit IgG (Light-Chain Specific) (D4W3E) mAb (#45262) 或 Mouse Anti-Rabbit IgG (Conformation Specific) (L27A9) mAb (#3678)(或 HRP conjugate #5127)作为二抗,以尽量减少变性兔重链产生的干扰。对于分子量大约为 25 kDa 的蛋白,建议使用 Mouse Anti-Rabbit IgG (Conformation Specific) (L27A9) mAb (#3678)(或 HRP conjugate #5127),以尽量减少变性小鼠重链或轻链产生的干扰。
当使用鼠源一抗检测分子量在 50 kDa 范围内的蛋白质时,我们建议使用 Rabbit Anti-Mouse IgG (Light Chain Specific) (D3V2A) mAb (HRP Conjugate) (#58802) 作为二抗,以尽量减少变性小鼠重链产生的干扰。
发布时间 2008 年 12 月
修订时间 2021 年 10 月
实验步骤编号:409
注:请参阅产品数据表或产品网页,了解合适的抗体稀释度^。
| 步骤 | 试剂 | 时间/温度 | |
|---|---|---|---|
| 1 | 脱蜡 | BOND™ Dewax Solution、100% 乙醇、BOND™ Wash Solution | 预编程的 Leica® BOND™ |
| 2 | 抗原修复 | BOND™ Epitope Retrieval ER2 Solution | 20 分钟,100˚C | 实验步骤:用 ER2 进行 20 分钟的热诱导表位修复 (HIER) |
| 3 | 过氧化物封闭液 | Refine Detection Kit Peroxide Block* | 5 分钟 |
| 洗涤 | BOND™ Wash Solution | 3x 0:00 分钟 | |
| 4 | 蛋白封闭液(可选) | #5425 NGS 或 #15019 Animal-Free Blocking Solution | 20 分钟 |
| 5 | 一抗^ | 用 #8112 SignalStain® Antibody Diluent 稀释 | 30 分钟 |
| 洗涤 | BOND™ Wash Solution | 3x 2:00 分钟 | |
| 不适用 | Post Primary Mouse Linker | Refine Detection Kit Post Primary* | 不适用 |
| 6 | 二次检测 | Refine Detection Kit Polymer* | 10 分钟 |
| 洗涤 | BOND™ Wash Solution/Deionized Water | 定制(参见下文) | |
| 7a | 可视化 | Refine Detection Kit Mixed DAB Refine* | 0:00 分钟 |
| 7b | 可视化 | Refine Detection Kit Mixed DAB Refine* | 10 分钟 |
| 洗涤 | 去离子水 | 3x 0:00 分钟 | |
| 8 | 复染 | Refine Detection Kit Hematoxylin* | 5 分钟 |
| 洗涤 | 去离子水 | 0:00 分钟 | |
| 洗涤 | BOND™ Wash Solution | 0:00 分钟 | |
| 洗涤 | 去离子水 | 0:00 分钟 | |
| 9 | 脱水(离线): | ||
| 在 95% 乙醇中孵育切片 2 次,每次 10 秒。 | |||
| 在 100% 乙醇中重复孵育 2 次,每次 10 秒。 | |||
| 在二甲苯中重复孵育 2 次,每次 10 秒。 | |||
| 10 | 用盖玻片和 #84583 SignalStain® Mounting Medium 封片。 | ||
| 可选订制洗涤: | BOND™ Wash Solution | 2:00 | |
| BOND™ Wash Solution | 分液器类型:开放式 0:00 | ||
| BOND™ Wash Solution | 2:00 | ||
| BOND™ Wash Solution | 分液器类型:开放式 0:00 | ||
| BOND™ Wash Solution | 0:00 | ||
| 去离子水 | 0:00 | ||
*BOND™ Polymer Refine Detection Kit(货号:DS9800)中所含的试剂
LEICA® 是 Leica Microsystems IR GmbH 的注册商标。
BOND™ 是 Leica Biosystems Melbourne Pty. Ltd 的商标。CST 和 Leica Microsystems IR GmbH 或 Leica Biosystems Melbourne Pty. Ltd 之间没有附属或赞助关系。
发布时间 2018 年 8 月
修订时间 2018 年 9 月
实验步骤编号:1444
注:使用反渗透去离子水 (RODI) 或同等级别的水配制溶液。
注意:在制作过程中务必随时保持切片处于湿润状态。
对于 EDTA:将切片浸入 1X EDTA 修复液中,再放入微波炉中加热直到沸腾;继续保持 15分钟的亚沸腾温度 (95°-98°C)。无需冷却。
| 推荐的 检测试剂 |
SignalStain® Boost IHC Detection Reagent (HRP, Rabbit) #8114 | SignalStain® Boost IHC Detection Reagent (AP, Rabbit) #18653 |
|---|---|---|
|
兼容的 色原 |
SignalStain® DAB Substrate Kit #8059 | SignalStain® Vibrant Red Alkaline Phosphatase Substrate Kit #76713 |
| SignalStain® Vivid Purple Peroxidase Substrate Kit #96632 | SignalStain® Ultra Blue Alkaline Phosphatase Substrate Kit #12824 | |
| SignalStain® Deep Black Peroxidase Substrate Kit #72986 | ||
| SignalStain® Radiant Yellow Peroxidase Substrate Kit #69644 |
注意:使用本实验步骤中未指定的检测试剂可能需要进一步优化一抗,考虑到检测试剂的不同灵敏度。
发布时间 2010 年 2 月
修订时间 2020 年 6 月
实验步骤编号:284
注意:用反渗透去离子 (RODI) 水或等效净化水制备溶液。
建议使用偶联荧光素的抗兔二抗:
注意:细胞应当在多孔板、腔室玻片或盖玻片上直接培养、处理、固定和染色。
注意:所有随后的孵育都应当在室温下完成,除非另有注明需要在避光湿盒或带盖的培养皿/板中孵育,以防止干燥和荧光物质淬灭。
发布时间 2006 年 11 月
修订时间 2010 年 12 月
实验步骤编号:32
本实验步骤中所需的所有试剂可与我们的 Intracellular Flow Cytometry Kit (Methanol) #13593 一起高效购买,或使用下文所列的货号单独购买。
注:使用反渗透去离子水 (RODI) 或同等级别的水配制溶液。
注:在您的实验中加入荧光细胞染料(包括活力指示染料、DNA 染料等)时,请参考染料产品网页,了解建议的实验步骤。访问 www.cellsignal.com,了解经验证用于流式细胞术的细胞染料完整列表。
注:固定前,贴壁细胞或组织应予以解离并处于单细胞悬液中。
注:最佳离心条件会根据细胞类型和试剂容量变动。一般,1-5 分钟 150-300g 将足以使细胞沉淀下来。
注:如果使用全血,则在固定前裂解红细胞并通过离心来洗涤。
注:如果表位被甲醛和/或甲醇破坏,可以在固定前添加靶向 CD 标记物或其他胞外蛋白质的抗体。在固定和透化过程期间,这类抗体将保持与目的靶标结合。但注意,某些荧光团(包括 PE 和 APC)会被甲醇损坏,因此不应在透化前添加。如果您不确定,请进行小规模实验。
注:使用血细胞计数器或备选方法计数细胞。
发布时间 2009 年 7 月
修订时间 2020 年 6 月
实验步骤编号:404
针对以下产品:SimpleChIP® Plus Sonication Chromatin IP Kit #56383。
包括的试剂:
未包括的试剂:
| ! | 这就表示在实验流程中基于免疫沉淀制备物(IP 制备物)数量的容积改变是重要的一步。一份 IP 制备物是指 4 x 106 个组织培养细胞或 25 mg 离体的组织。 |
| !! | 这就表示,进行操作前稀释缓冲液是重要的一步。 |
| 安全停止 | 如果需要停止,这是实验步骤中的一个安全停止点。 |
收获组织时,去除样品中不需要的物质,如脂肪和坏死物质。组织可以立即处理和交联,或放在干冰上冷冻供后续处理。为获得最佳 ChIP 结果,每次免疫沉淀使用 25 mg 组织。应额外处理 5 mg 组织用于“分析染色质消化和浓度”,并用作输入染色质(第四部分)。不同组织类型的染色质产率不尽相同,每次免疫沉淀时,某些组织可能需要超过 25 mg。
一次染色质制备量规定为 100 至 150 mg 组织。对于某些组织类型,这种建议的组织量可能会导致低产率,但在超声处理过程中可确保高效的染色质碎裂。有关不同组织类型的预期染色质产率的更多信息,请参见附录 A。
在开始之前:
(!) 所有缓冲液体积应根据实验中染色质制备物的数量按比例添加。
为获得最佳 ChIP 结果,每次免疫沉淀使用大约 4 x 106 个细胞。对于 HCT 116 细胞,这相当于 15 cm 培养皿所含细胞(在 20 ml 生长培养基中的融合度为 90%)的 1/3。应额外处理 1 x 106 个细胞用于“分析染色质消化和浓度”,并用作输入染色质(第四部分)。
一次染色质制备量规定为 1 x 107 至 2 x 107 个细胞。对于某些细胞类型,这种建议的细胞量可能会导致低产率,但在超声处理过程中可确保高效的染色质碎裂。
在开始之前:
(!) 所有缓冲液体积应根据实验中使用的 15 cm 组织培养皿(或 20 ml 悬浮细胞)的数量按比例增加。
一次染色质制备量规定为 100-150 mg 组织或 1 x 107-2 x 107 个组织培养细胞。可以同时进行多份染色质制备,只要相应增加缓冲液用量并对 1 ml 样品进行超声处理。超声处理所使用的细胞数量和样品量对于产生合适大小的染色质片段非常关键。
在开始之前:
(!) 所有缓冲液体积应根据实验中染色质制备物的数量按比例添加。
为获得最佳 ChIP 结果,每次免疫沉淀使用大约 5-10 μg 经超声处理的交联染色质(第 四 部分中确定的量)。这应大致相当于用 25 mg 离散组织或 4x106 个组织培养细胞制备的一份 100 µl 免疫沉淀制备物。在添加抗体之前,通常将 100μl 消化的染色质稀释到 400μl 1X ChIP 缓冲液中。但如果每次免疫沉淀需要多于 100 µl 的染色质,则必须将交联染色质制备物按 1:4 的稀释比例在 1X ChIP 缓冲液中稀释。在这种情况下,无需添加 蛋白 G 磁珠,尽管延长用微珠孵育的时间比较有用。
在开始之前:
(!) 所有缓冲液的用量都应按照实验中免疫沉淀物的数量成比例的增加。
注意:对于 Cell Signaling Technology 的多数抗体,每份免疫沉淀样品使用 1-2 µg 时的效果最佳。如有多份不同浓度的样品,最好让阴性对照 Normal Rabbit IgG #2729 与最高抗体浓度相匹配。
在开始之前:
(!) 所有缓冲液的用量都应按照实验中免疫沉淀物的数量成比例的增加。
在开始之前:
建议:
| 引物长度: | 24 个核苷酸 |
| 最佳 Tm: | 60℃ |
| 最佳 GC: | 50% |
| 扩增子尺寸: | 150 至 200 bp(标准 PCR) |
| 80 至 160 bp(实时荧光定量 PCR) |
标准 PCR 方法:
| 试剂 | 1 次 PCR 反应所需体积 (18 μl) |
|---|---|
| 无核酸酶的 H2O | 12.5 μl |
| 10X PCR 缓冲液 | 2.0 μl |
| 4mM dNTP 混合物 | 1.0 μl |
| 5 μM RPL30 引物 | 2.0 μl |
| Taq DNA 聚合酶 | 0.5 μl |
实时荧光定量 PCR 方法:
| 试剂 | 1 次 PCR 反应所需体积 (18 μl) |
|---|---|
| 无核酸酶的 H2O | 6 μl |
| 5 μM RPL30 引物 | 2 μl |
| SimpleChIP® Universal qPCR Master Mix #88989 | 10 μl |
| a. | 初始变性 | 95℃ 3 分钟 |
| b. | 变性 | 95℃ 15 秒 |
| c. | 复性和延伸: | 60℃ 60 秒 |
| d. | 重复步骤 b 和 c,共循环 40 次。 |
输入百分比 = 2% x 2(C[T] 2% 输入样品 - C[T] 免疫沉淀样品)
C[T] = CT = PCR 反应的平均循环阈值
用这种试剂盒制备的免疫富集的 DNA 样品可用于 ChIP-seq 。要构建下游 NG 测序用 DNA 文库,请使用与您的下游测序平台相容的 DNA 文库制备实验步骤或试剂盒。对于 Illumina® 平台上测序,我们建议使用 DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 及其相关索引引物 Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 或 Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538。
建议:
从组织样品收获交联的染色质时,组织类型之间的染色质产率可能显著不同。右表提供用 100 mg 组织与 2 x 107 个 HCT 116 细胞制备的染色质的预期产量范围,以及实验步骤第 四 部分确定的预期 DNA 浓度。为了获得最佳 ChIP 结果,我们建议使用 DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 及其相关索引引物 Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 或 Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538。
| 组织/细胞 | 染色质总产率 | 预期 DNA 浓度 |
|---|---|---|
| 肝 | 每 100 mg 组织使用 50 µg | 150 µg/ml |
| 脑 | 每 100 mg 组织使用 25 µg | 50 µg/ml |
| 心脏 | 每 100 mg 组织使用 105 µg | 20 µg/ml |
| HCT 116 | 100-150 μg/2 x 107 个细胞 | 100-150 μg/ml |
转录因子和辅因子结合染色质 DNA 没有结合组蛋白紧密。因此,它们在超声处理期间容易脱离染色质。在 ChIP 实验中,延长固定时间能捕获更多转录因子和辅因子,尤其是使用组织样品时。如图 7 所示,固定时间从 10 分钟延长至 30 分钟可能会减小染色质片段(左小图),但 ChIP-qPCR 表明,这会显著增加心脏组织中辅因子 RING1B 和 SUZ12 的富集(中间小图和右小图)。
通常,对于同时使用细胞和组织样品的组蛋白修饰 ChIP,10 分钟固定即可,而转录因子和辅因子可能需要长达 30 分钟的额外固定时间,尤其是使用组织样品时。
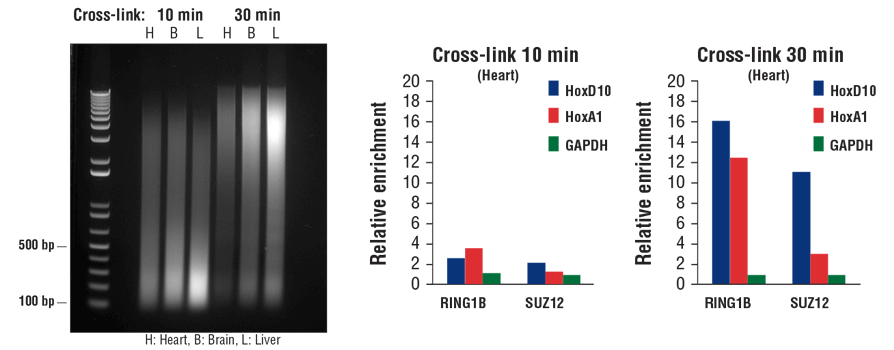
图 7. 使小鼠心脏 (H)、脑 (B) 和肝 (L) 细胞交联 10 分钟或 30 分钟,如图所示(左小图)。染色质制备后进行声处理,对 DNA 进行纯化并用 1% 琼脂糖凝胶进行电泳来分离。在 ChIP-qPCR 检测(中间和右小图)中,使用 RING1B (D22F2) XP® 兔单克隆抗体 #5694 或 SUZ12 (D39F6) XP® 兔单克隆抗体 #3737 进行染色质免疫沉淀。使用 SimpleChIP® Mouse HoxD10 Exon 1 Primers #7429、SimpleChIP® Mouse HoxA1 Promoter Primers #7341 和 SimpleChIP® Mouse GAPDH Intron 2 Primers #8986,通过实时 PCR 对富集的 DNA 进行定量分析。每份样品中免疫沉淀 DNA 的数量表示为向阴性 GAPDH 基因座发出的标准化信号(等于 1)。
交联染色质 DNA 碎裂的最佳条件高度依赖于使用的细胞数量、样品体积、超声处理时长和超声波仪功率设置。对于每份经声处理的样品,我们建议每 1 ml ChIP 声处理胞核裂解缓冲液用 100-150 mg 组织或 1 x 107-2 x 107 个细胞。 以下是确定某种特定组织或细胞类型的最佳超声处理条件的实验步骤。
注意:使用不同样品类型和固定时间时,最佳超声处理条件也不同。使用产生所需长度染色质片段需要的最少超声处理循环次数。超过 80% 短于 500 bp 的总 DNA 片段表明,过分超声处理会导致染色质过度受损,并会降低免疫沉淀效率(见图 8,右小图)
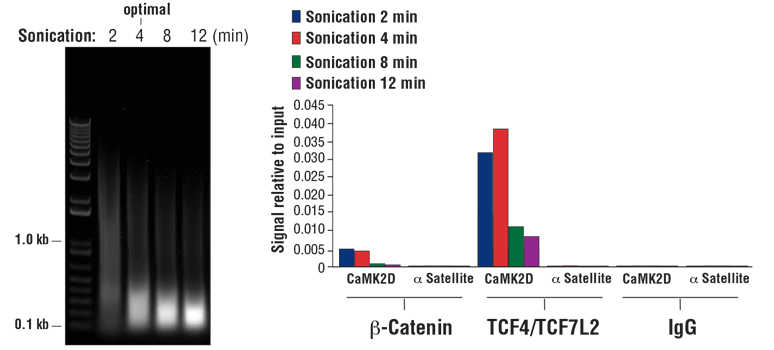
图 8. 将 HCT 116 细胞交联 10 分钟,并对其进行规定时间的声处理(左小图)。DNA 按照 SimpleChIP® Plus 超声法染色体免疫共沉淀试剂盒 #56383 的第四部分的说明进行纯化,并用 1% 琼脂糖凝胶进行电泳来分离出 20 µl 纯化的 DNA。如左小图所示,增加超声处理循环次数会减小染色质片段的大小。使用 SimpleChIP® Plus 超声法染色体免疫共沉淀试剂盒 #56383 对非磷酸化(活性)β-连环蛋白 (Ser33/37/Thr41) (D13A1) 兔单克隆抗体 #8814、TCF4/TCF7L2 (C48H11) 兔单克隆抗体 #2569 或正常兔 IgG #2729 进行染色质免疫沉淀。使用 SimpleChIP® Human CaMK2D Intron 3 Primers #5111 和 SimpleChIP® Human α Satellite Repeat Primers #4486,通过实时 PCR 对富集的 DNA 进行定量分析。每份样品中免疫沉淀的 DNA 数量表示为与输入染色质总量相对应的信号(等于 100%;右小图)。如图所示,使用配有 1/8 英寸微探头的 Branson Digital Sonifier D250 探头超声波仪时,4 分钟的染色质声处理最佳。过度超声处理会明显有损辅因子 β-catenin 和包含染色质的转录因子 TCF4/TCF7L2 的富集。
| 问题 | 可能的原因 | 建议 |
|---|---|---|
| 1. 碎裂染色质的浓度过低。 |
细胞/细胞核裂解不完全。 染色质制备没有使用足够细胞。 |
如果染色质制备物的 DNA 浓度接近于 50 μg/ml,则向每次 IP 中添加额外的染色质以确保每次 IP 至少产生 5 μg,然后继续实验。 交联前,对单独平板上的细胞进行计数,以确定准确的细胞数量。 |
| 2. 染色质碎裂不足,且片段过大(超过 50% 的片段大于 1.5 kb)。 |
细胞可能已经过度交联。 处理了过多细胞/组织。 |
将交联时间缩短到 10-30 分钟的范围。减少每次超声处理的细胞/组织数量。进行超声处理时程。 |
| 3. 染色质过度碎裂(超过 90% 的片段小于 300 bp)。 |
超声处理条件太苛刻。 |
进行一次超声处理时程来找到进行相应超声处理的最小输出/时长。 |
| 4. 样品输入对照组 PCR 反应中无产物或产物很少。 |
添加至 PCR 反应的 DNA 不足或条件不是最佳。 PCR 扩增区域可能跨越无核小体的区域。 加入到免疫沉淀的染色质不足,或染色质被过度超声处理。 |
向 PCR 反应中添加更多 DNA 或增加扩增循环次数。 使用从交联并经超声处理的染色质中获得的纯化 DNA 来优化针对实验用引物组的 PCR 条件。为获得最佳 ChIP 结果,每次 IP 添加 5-10 μg 染色质。参见上述问题 1 和 3 的建议。 |
| 5. 阳性对照组蛋白 H3-IP RPL30 PCR 反应中无产物。 |
添加至 IP 反应的染色质或抗体不足,或者 IP 孵育时间过短。 蛋白 G 微珠中染色质洗脱不完全。 |
确保每次免疫沉淀反应添加 5-10 µg 染色质和 10 µl 抗体,并用抗体孵育过夜,添加蛋白 G 微珠之后再孵育 2 小时。 在 65℃ 下将染色质从蛋白 G 微珠洗脱为最佳,同时频繁混合以保持微珠悬浮在溶液中。 |
| 6. 阴性对照 Rabbit IgG-IP 和阳性对照 Histone H3-IP PCR 反应中产物的数量相等。 |
添加至 IP 反应的染色质过多或不足。或者,添加至 IP 反应的抗体过多。 添加至 PCR 反应的 DNA 过多或扩增循环次数过多。 |
向每次 IP 反应中添加不超过 15 μg 的染色质和 10 μl Histone H3 Antibody。每次 IP 将 Normal Rabbit IgG 缩减至1 µl/IP。 向 PCR 反应中添加更少的 DNA 或减少 PCR 循环次数。在 PCR 的线性扩增阶段范围内分析 PCR 产物极为重要。否则,起始 DNA 数量的差异无法准确测量。 |
| 7. 实验抗体 IP PCR 反应中无产物。 |
添加至 PCR 反应的 DNA 不足。 添加至 IP 反应的抗体不足。 抗体不适用于 IP。 |
向 PCR 反应中添加更多 DNA 或增加扩增循环次数。 通常,免疫沉淀反应需添加 1-5 µg 抗体;但准确的用量在很大程度上取决于具体抗体。 增加添加至 IP 反应的抗体量。寻找其他替代抗体。 |
发布时间 2017 年 3 月
修订时间 2022 年 4 月
实验步骤编号:1384
针对以下产品:SimpleChIP® Plus Sonication Chromatin IP Kit #56383。
收获组织时,去除样品中不需要的物质,如脂肪和坏死物质。组织可以立即处理和交联,或放在干冰上冷冻供后续处理。为获得最佳 ChIP 结果,每次免疫沉淀使用 25 mg 组织。应额外处理 5 mg 组织用于“分析染色质消化和浓度”,并用作输入染色质(第四部分)。不同组织类型的染色质产率不尽相同,每次免疫沉淀时,某些组织可能需要超过 25 mg。
一次染色质制备量规定为 100 至 150 mg 组织。对于某些组织类型,这种建议的组织量可能会导致低产率,但在超声处理过程中可确保高效的染色质碎裂。有关不同组织类型的预期染色质产率的更多信息,请参见附录 A。
在开始之前:
为获得最佳 ChIP 结果,每次免疫沉淀使用大约 4 x 106 个细胞。对于 HCT 116 细胞,这相当于 15 cm 培养皿所含细胞(在 20 ml 生长培养基中的融合度为 90%)的 1/3。应额外处理 1 x 106 个细胞用于“分析染色质消化和浓度”,并用作输入染色质(第四部分)。
一次染色质制备量规定为 1 x 107 至 2 x 107 个细胞。对于某些细胞类型,这种建议的细胞量可能会导致低产率,但在超声处理过程中可确保高效的染色质碎裂。
在开始之前:
一次染色质制备量规定为 100-150 mg 组织或 1 x 107-2 x 107 个组织培养细胞。可以同时进行多份染色质制备,只要相应增加缓冲液用量并对 1 ml 样品进行超声处理。超声处理所使用的细胞数量和样品量对于产生合适大小的染色质片段非常关键。
在开始之前:
为获得最佳 ChIP 结果,每次免疫沉淀使用大约 5-10 μg 经超声处理的交联染色质(第 四 部分中确定的量)。这应大致相当于用 25 mg 离散组织或 4x106 个组织培养细胞制备的一份 100 µl 免疫沉淀制备物。在添加抗体之前,通常将 100μl 消化的染色质稀释到 400μl 1X ChIP 缓冲液中。但如果每次免疫沉淀需要多于 100 µl 的染色质,则必须将交联染色质制备物按 1:4 的稀释比例在 1X ChIP 缓冲液中稀释。在这种情况下,无需添加 蛋白 G 磁珠,尽管延长用微珠孵育的时间比较有用。
在开始之前:
注意:对于 Cell Signaling Technology 的多数抗体,每份免疫沉淀样品使用 1-2 µg 时的效果最佳。如有多份不同浓度的样品,最好让阴性对照 Normal Rabbit IgG #2729 与最高抗体浓度相匹配。
在开始之前:
在开始之前:
建议:
| 引物长度: | 24 个核苷酸 |
| 最佳 Tm: | 60℃ |
| 最佳 GC: | 50% |
| 扩增子尺寸: | 150 至 200 bp(标准 PCR) |
| 80 至 160 bp(实时荧光定量 PCR) |
标准 PCR 方法:
| 试剂 | 1 次 PCR 反应所需体积 (18 μl) |
|---|---|
| 无核酸酶的 H2O | 12.5 μl |
| 10X PCR 缓冲液 | 2.0 μl |
| 4mM dNTP 混合物 | 1.0 μl |
| 5 μM RPL30 引物 | 2.0 μl |
| Taq DNA 聚合酶 | 0.5 μl |
实时荧光定量 PCR 方法:
| 无核酸酶的 H2O | 6 μl |
| 5 μM RPL30 引物 | 2 μl |
| SimpleChIP® Universal qPCR Master Mix #88989 | 10 μl |
| a. | 初始变性 | 95℃ 3 分钟 |
| b. | 变性 | 95℃ 15 秒 |
| c. | 复性和延伸: | 60℃ 60 秒 |
| d. | 重复步骤 b 和 c,共循环 40 次。 |
输入百分比 = 2% x 2(C[T] 2% 输入样品 - C[T] 免疫沉淀样品)
C[T] = CT = PCR 反应的平均循环阈值
用这种试剂盒制备的免疫富集的 DNA 样品可用于 ChIP-seq 。要构建下游 NG 测序用 DNA 文库,请使用与您的下游测序平台相容的 DNA 文库制备实验步骤或试剂盒。对于 Illumina® 平台上测序,我们建议使用 DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 及其相关索引引物 Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 或 Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538。
建议:
从组织样品收获交联的染色质时,组织类型之间的染色质产率可能显著不同。右表提供用 100 mg 组织与 2 x 107 个 HCT 116 细胞制备的染色质的预期产量范围,以及实验步骤第 四 部分确定的预期 DNA 浓度。为了获得最佳 ChIP 结果,我们建议使用 DNA Library Prep Kit for Illumina® (ChIP-seq, CUT&RUN) #56795 及其相关索引引物 Multiplex Oligos for Illumina® (Single Index Primers) (ChIP-seq, CUT&RUN) #29580 或 Multiplex Oligos for Illumina® (Dual Index Primers) (ChIP-seq, CUT&RUN) #47538。
| 组织/细胞 | 染色质总产率 | 预期 DNA 浓度 |
|---|---|---|
| 肝 | 每 100 mg 组织使用 50 µg | 150 µg/ml |
| 脑 | 每 100 mg 组织使用 25 µg | 50 µg/ml |
| 心脏 | 每 100 mg 组织使用 105 µg | 20 µg/ml |
| HCT 116 | 100-150 μg/2 x 107 个细胞 | 100-150 μg/ml |
转录因子和辅因子结合染色质 DNA 没有结合组蛋白紧密。因此,它们在超声处理期间容易脱离染色质。在 ChIP 实验中,延长固定时间能捕获更多转录因子和辅因子,尤其是使用组织样品时。如图 7 所示,固定时间从 10 分钟延长至 30 分钟可能会减小染色质片段(左小图),但 ChIP-qPCR 表明,这会显著增加心脏组织中辅因子 RING1B 和 SUZ12 的富集(中间小图和右小图)。
通常,对于同时使用细胞和组织样品的组蛋白修饰 ChIP,10 分钟固定即可,而转录因子和辅因子可能需要长达 30 分钟的额外固定时间,尤其是使用组织样品时。

图 7. 使小鼠心脏 (H)、脑 (B) 和肝 (L) 细胞交联 10 分钟或 30 分钟,如图所示(左小图)。染色质制备后进行超声处理,DNA 进行纯化并通过对 1% 琼脂糖凝胶进行电泳来分离 20 µl。在 ChIP-qPCR 检测(中间小图和右小图)中,使用 10 µl RING1B (D22F2) XP® Rabbit mAb #5694 或 5 µl SUZ12 (D39F6) XP® Rabbit mAb #3737 进行染色质免疫沉淀。使用 SimpleChIP® Mouse HoxD10 Exon 1 Primers #7429、SimpleChIP® Mouse HoxA1 Promoter Primers #7341 和 SimpleChIP® Mouse GAPDH Intron 2 Primers #8986,通过实时 PCR 对富集的 DNA 进行定量分析。每份样品中免疫沉淀 DNA 的数量表示为向阴性 GAPDH 基因座发出的标准化信号(等于 1)。
交联染色质 DNA 碎裂的最佳条件高度依赖于使用的细胞数量、样品体积、超声处理时长和超声波仪功率设置。对于每份声处理样品,我们建议每 1 ml ChIP Sonication Nuclear Lysis Buffer 使用 100-150 mg 组织或 1 x 107 - 2 x 107 个细胞。 以下是确定某种特定组织或细胞类型的最佳超声处理条件的实验步骤。
注意:使用不同样品类型和固定时间时,最佳超声处理条件也不同。使用产生所需长度染色质片段需要的最少超声处理循环次数。超过 80% 短于 500 bp 的总 DNA 片段表明,过分超声处理会导致染色质过度受损,并会降低免疫沉淀效率(见图 8,右小图)

图 8. 对交联 10 分钟并经超声处理规定时长的 2 x 107 个 HCT 116 细胞进行染色质免疫沉淀(左小图)。DNA 按照 SimpleChIP® Plus Sonication Chromatin IP Kit #56383 的第 四 部分的说明进行纯化,并在 1% 琼脂糖凝胶上进行电泳来分离 20 µl 纯化 DNA。如左小图所示,增加超声处理循环次数会减小染色质片段的大小。使用 SimpleChIP® Plus Sonication Chromatin IP Kit #56383 对 5 µl Non-phospho (Active) Β-Catenin (Ser33/37/Thr41) (D13A1) Rabbit mAb #8814、10 µl TCF4/TCF7L2 (C48H11) Rabbit mAb #2569 或 2 µl Normal Rabbit IgG #2729 进行染色质免疫沉淀。使用 SimpleChIP® Human CaMK2D Intron 3 Primers #5111 和 SimpleChIP® Human α Satellite Repeat Primers #4486,通过实时 PCR 对富集的 DNA 进行定量分析。每份样品中免疫沉淀 DNA 的数量表示为与输入染色质的总量(等于 1;右小图)相对应的信号。如图所示,使用配有 1/8 英寸微探头的 Branson Digital Sonifier D250 探头超声波仪时,4 分钟的染色质声处理最佳。过度超声处理会明显有损辅因子 β-catenin 和包含染色质的转录因子 TCF4/TCF7L2 的富集。
| 问题 | 可能的原因 | 建议 |
|---|---|---|
| 1. 碎裂染色质的浓度过低。 |
细胞/细胞核裂解不完全。 染色质制备没有使用足够细胞。 |
如果染色质制备物的 DNA 浓度接近于 50 μg/ml,则向每次 IP 中添加额外的染色质以确保每次 IP 至少产生 5 μg,然后继续实验。 交联前,对单独平板上的细胞进行计数,以确定准确的细胞数量。 |
| 2. 染色质碎裂不足,且片段过大(超过 50% 的片段大于 1.5 kb)。 |
细胞可能已经过度交联。 处理了过多细胞/组织。 |
将交联时间缩短到 10-30 分钟的范围。减少每次超声处理的细胞/组织数量。进行超声处理时程。 |
| 3. 染色质过度碎裂(超过 90% 的片段小于 300 bp)。 |
超声处理条件太苛刻。 |
进行一次超声处理时程来找到进行相应超声处理的最小输出/时长。 |
| 4. 样品输入对照组 PCR 反应中无产物或产物很少。 |
添加至 PCR 反应的 DNA 不足或条件不是最佳。 PCR 扩增区域可能跨越无核小体的区域。 加入到免疫沉淀的染色质不足,或染色质被过度超声处理。 |
向 PCR 反应中添加更多 DNA 或增加扩增循环次数。 使用从交联并经超声处理的染色质中获得的纯化 DNA 来优化针对实验用引物组的 PCR 条件。为获得最佳 ChIP 结果,每次 IP 添加 5-10 μg 染色质。参见上述问题 1 和 3 的建议。 |
| 5. 阳性对照组蛋白 H3-IP RPL30 PCR 反应中无产物。 |
添加至 IP 反应的染色质或抗体不足,或者 IP 孵育时间过短。 蛋白 G 微珠中染色质洗脱不完全。 |
确保每次免疫沉淀反应添加 5-10 µg 染色质和 10 µl 抗体,并用抗体孵育过夜,添加蛋白 G 微珠之后再孵育 2 小时。 在 65℃ 下将染色质从蛋白 G 微珠洗脱为最佳,同时频繁混合以保持微珠悬浮在溶液中。 |
| 6. 阴性对照 Rabbit IgG-IP 和阳性对照 Histone H3-IP PCR 反应中产物的数量相等。 |
添加至 IP 反应的染色质过多或不足。或者,添加至 IP 反应的抗体过多。 添加至 PCR 反应的 DNA 过多或扩增循环次数过多。 |
向每次 IP 反应中添加不超过 15 μg 的染色质和 10 μl Histone H3 Antibody。每次 IP 将 Normal Rabbit IgG 缩减至1 µl/IP。 向 PCR 反应中添加更少的 DNA 或减少 PCR 循环次数。在 PCR 的线性扩增阶段范围内分析 PCR 产物极为重要。否则,起始 DNA 数量的差异无法准确测量。 |
| 7. 实验抗体 IP PCR 反应中无产物。 |
添加至 PCR 反应的 DNA 不足。 添加至 IP 反应的抗体不足。 抗体不适用于 IP。 |
向 PCR 反应中添加更多 DNA 或增加扩增循环次数。 通常,免疫沉淀反应需添加 1-5 µg 抗体;但准确的用量在很大程度上取决于具体抗体。 增加添加至 IP 反应的抗体量。寻找其他替代抗体。 |
发布时间 2017 年 3 月
修订时间 2022 年 4 月
实验步骤编号:1404
人, 小鼠, 大鼠, 猴
仓鼠 , 牛 , 猪 , 马
使用与小鼠 Stat3 中 Tyr705 周围残基相对应的合成磷酸肽,对动物进行免疫接种来产生单克隆抗体。
Stat3 转录因子是众多细胞因子和生长因子受体的重要信号转导 (1),对胎鼠发育必不可少 (2)。研究显示 Stat3 在多种人类肿瘤中持续激活 (3,4) ,并有致癌的潜在可能性 (5),具有抗凋亡活性 (3)。Stat3 通过 Tyr705 位点的磷酸化而激活,从而诱导二聚化、核转位、DNA 结合 (6,7)。转录激活似乎受到 MAPK 或 mTOR 通路介导的 Ser727 位点磷酸化的调控 (8,9)。Stat3 同工型的表达反应了生物学功能,Stat3α (86 kDa) 和 Stat3β (79 kDa) 相对表达水平,依赖于细胞类型、配体暴露或者细胞发育的成熟阶段 (10) 。值得注意的是,Stat3β 蛋白在羧基末端转录激活结构域缺少丝氨酸磷酸化位点 (8)。
探索与本品相关的通路。
除非如以 CST 合法授权代表签署的书面形式另行明确同意,否则以下条款适用于 CST、其附属公司或其分销商提供的产品。除非 CST 合法授权代表以书面形式单独接受,否则任何附加于或异于此处所载条款和条件的客户条款和条件均被拒绝且无效。
产品用“仅供研究使用”或类似标示声明标示,并且尚未经 FDA 或其他国外或国内监管实体出于任何目的批准、准许或许可。客户不得出于任何诊断或治疗目的或以任何与产品标示声明相冲突的方式使用任何产品。CST 销售或许可的产品提供给作为最终用户的客户,且仅用于研究和开发用途。出于诊断、预防或治疗目的任何产品使用或出于转售(单独或作为成分)或其他商业目的的任何产品购买都要求来自 CST 的单独许可。客户 (a) 不得向任何第三方出售、许可、出借、捐赠或另行转让或提供任何本公司产品,无论单独或联合其他材料方式,或使用本公司产品制造任何商业产品,(b) 不得复制、修改、逆向工程、反编译、反汇编或另行尝试发现本公司产品的底层结构或技术,或出于开发与 CST 产品或服务竞争的任何产品或服务的目的使用本公司产品,(c) 不得从本公司产品改变或移除任何商标、商品名称、徽标、专利或版权声明或标记,(d) 仅应根据 CST 产品销售条款和任何适用文档使用本公司产品,以及 (e) 应就客户联系本公司产品所用的任何第三方产品或服务而言遵守任何许可、服务条款或类似协议。